Un estudio ayuda a entender cómo se regula el metabolismo energético a nivel celular
Brasil: CIENCIAS DE LA VIDA / BIOLOGÍA CELULAR.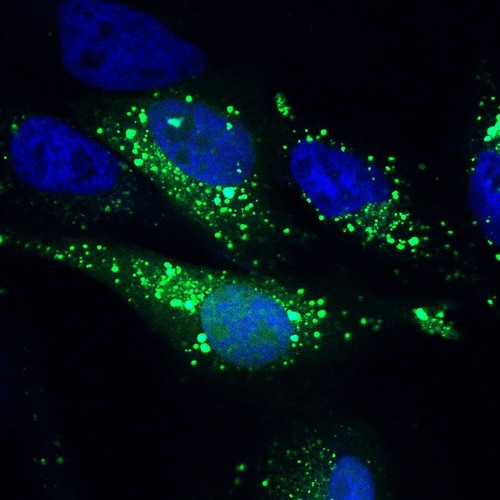
Un artículo publicado revela la relación entre el transporte de calcio en el interior de las mitocondrias y el proceso de autofagia, a través del cual las células degradan y reaprovechan una parte de sus componentes.
Células en proceso de autofagia.
Un estudio brasileño publicado en el Faseb Journal ayuda a entender de qué manera se correlacionan dos procesos fundamentales en la regulación del metabolismo energético: la captación y la liberación de iones de calcio a cargo de las mitocondrias (los orgánulos que generan la energía de las células) y la autofagia (el proceso mediante el cual las células degradan y reaprovechan partes del propio citoplasma) inducida por restricción calórica.
El referido trabajo se llevó a cabo en el Centro de Procesos Rédox en Biomedicina (Redoxoma), un Centro de Investigación, Innovación y Difusión (CEPID) de la FAPESP con sede en el Instituto de Química de la Universidad de São Paulo (IQ-USP).
Bajo la conducción de la profesora Alicia Kowaltowski, los investigadores del Redoxoma demostraron que el transportador responsable de la salida de iones de calcio de las mitocondrias, la proteína NCLX, es un importante nudo regulador que integra a las mitocondrias, junto al control de la autofagia a cargo de los iones de calcio y las respuestas celulares, con la disponibilidad de nutrientes. De este modo, establecieron la relación entre la autofagia y el calcio mitocondrial.
“Este trabajo es importante, pues concretamos el enlace entre esos procesos. Tanto las mitocondrias como la autofagia están implicadas en el metabolismo y, por ende, tiene sentido que exista una coordinación entre ellas. Normalmente, cuando se estudia la biología celular, las cosas se ven por separado, pero debemos recordar que en las células un proceso depende del otro, uno regula al otro. Y pese a ser un trabajo de ciencia básica, que parece un tanto abstracto, este conocimiento puede aplicarse seguramente en contextos patológicos para el desarrollo de blancos terapéuticos”, afirma Vitor de Miranda Ramos, investigador del Redoxoma y primer autor del artículo.
Miranda Ramos realizó parte de este estudio en el laboratorio del profesor Viktor Korolchuk, de la Newcastle University (Inglaterra), con el apoyo de una Beca de Pasantía de Investigación en el Exterior (BEPE) de la FAPESP. Aparte de generar la energía destinada a las células, las mitocondrias participan directamente en varias vías de regulación celular sensibles al calcio, pues son capaces de captar, absorber y liberar iones de calcio.
La captación mitocondrial de los iones de calcio es mediada por el complejo uniportador de calcio mitocondrial (MCU, las siglas en inglés de Mitochondrial Calcium Uniporter), mientras que el intercambiador mitocondrial Na+/Li+/Ca2+ (NCLX) mueve iones de calcio desde la matriz mitocondrial hacia el espacio situado entre la membrana interna y la externa, a cambio de iones de sodio. El calcio afecta casi todos los aspectos de la vida celular. Los iones de calcio son segundos mensajeros conocidos en la señalización metabólica y cumplen un importante papel en la regulación de la autofagia.
El reciclado celular.
La autofagia es un proceso evolutivamente conservado de degradación y reciclado de componentes celulares, cuyo papel basal consiste en mantener la homeostasis celular. Por su habilidad para remover elementos indeseables y promover la disponibilidad de nutrientes, la autofagia es necesaria para llevar a cabo el control de calidad, la renovación tisular y la regulación metabólica. Aparte de su función basal, este proceso también se activa como respuesta a la disminución de la disponibilidad de nutrientes, por eso se lo considera como uno de los mecanismos responsables de los beneficios de la restricción calórica.
En el referido trabajo, y como punto de partida para entender la interacción entre el transporte mitocondrial de calcio y la autofagia, los investigadores sometieron a un grupo de ratones a cuatro meses de restricción calórica y observaron que las mitocondrias aisladas del hígado de esos animales contenían niveles más elevados de NCLX que las de los animales sometidos a una dieta con acceso ilimitado al alimento. A partir de ello, y valiéndose de células hepáticas en cultivo, crearon modelos para mimetizar la restricción calórica y observaron nuevamente el aumento de la expresión de NCLX.
El mecanismo.
Con base en diferentes mediciones efectuadas en diversas etapas del proceso de autofagia, los investigadores descubrieron que la actividad de NCLX tiene efectos sobre los pasos iniciales de la maquinaria autofágica. En la autofagia, los autofagosomas (las estructuras que crean las células para envolver a los componentes que se degradarán) secuestran componentes celulares, y a su vez se funden con los lisosomas para promover la digestión de orgánulos o proteínas. Con los datos obtenidos en el estudio, los científicos arribaron a la conclusión de que la alteración del calcio intracelular resultante de la inactivación de NCLX interfiere en la formación de los autofagosomas, en detrimento de las etapas iniciales de la autofagia.
A diferencia de lo que sería de esperarse, los investigadores también observaron que la inhibición de NCLX no alteró la producción de ATP (trifosfato de adenosina, una molécula que se emplea en la producción de energía) en las mitocondrias, ni afectó a la vía de la proteína quinasa activada por AMP (AMPK), que se activa cuando la energía se encuentra baja en las células. “A decir verdad, esta regulación de la autofagia que realiza el NCLX está ocurriendo a causa del calcio celular independiente de esa vía”, dice Kowaltowski.
Según los investigadores, se hace necesarios más estudios a los efectos de dilucidar los complejos mecanismos de control de la autofagia a cargo del calcio citoplasmático. “Obviamente, la señalización del calcio es sumamente compleja, incluso quizá es promiscua en las células, pues muchas proteínas pueden unirse al calcio y que éste las regule; por eso se hace difícil llegar a un mecanismo específico”, comenta Miranda Ramos.
El cerebro emplea mucha energía y necesita muchas mitocondrias. La acumulación de daños en las células puede provocar la muerte celular y derivar en el desarrollo de patologías. “Pese a que no hemos observado específicamente contextos patológicos, este nexo entre la señalización de calcio y la autofagia resulta interesante, pues puede erigirse como una idea de progresión en alguna enfermedad. Al perder la actividad de ese transportador, se generan más daños, y el proceso necesario para limpiar esos danos –la autofagia– se encuentra deteriorado. Esto abre perspectivas para la concreción de trabajos futuros”, subraya Kowaltowski.
AGÊNCIA FAPESP/DICYT.
Sitio Fuente: DICyT